
On va l'hidrogen i altres discussions sobre la taula periòdica
-
- Home
-
- 8 of 22

Taula periòdica invertida de Poliakoff, proposada el 2019
La taula periòdica, en estat no estacionari
A vegades els científics fan la impressió, amb els seus escrits i conferències, que la ciència ha anat progressant gradualment fins a un estat, l'actual, que –sense explicitar-ho– consideren força definitiu. Però, a vegades, aquest estat no és tan estable com pot semblar... Referint-nos a la taula periòdica dels elements químics la progressió que hi ha hagut des de les primeres versions de Mendeléiev fins a la forma actual és evident, i sembla que no pugui evolucionar. Amb la síntesi dels darrers elements, fins al 118, s'ha dit per part de molts comentaristes que "la taula periòdica ja s'ha completat". Però això no és pas així.
Hi ha hagut dos moments culminants en l'evolució de la taula periòdica. El primer moment va ser el del seu naixement, a càrrec de Dmitri Mendeléiev el 1869, quan es va constatar que els elements ordenats segons una propietat no trivial com és el seu pes atòmic permetia una estructura en què es veien clarament certes regularitats en les propietats. A més, aquesta regularitat permetia deixar certs buits en l'ordenació, corresponents a elements postulats però encara no descoberts. Cal destacar que aquesta ordenació és, en certa manera, contraintuïtiva, perquè no té absolutament res a veure l'ordenació per pesos atòmics –determinats experimentalment a partir dels pesos de combinació– amb l'ordenació per densitats –també denominades pesos específics–, determinades a partir de manipulacions relativament senzilles. Els exemples més cridaners són els de gasos –el nitrogen, per exemple– de densitat molt baixa, però que tenen un pes atòmic superior que alguns sòlids, de densitat molt més alta, com el beril·li; per no citar el cas del radó, encara no conegut quan es feia l'ordenació per pesos atòmics, i que té més pes atòmic que el 85% d'elements de la taula periòdica.
El segon moment culminant en l'evolució de la taula periòdica fou el descobriment dels espectres d'emissió dels elements, per part de Van den Broek i Moseley, el 1913, que, juntament amb els descobriments de l'electró i del nucli atòmic, i amb els primers models atòmics de Bohr, van permetre postular l'estructura electrònica dels àtoms i la definició del nombre atòmic Z. L'ordenació dels elements seguint l'ordre creixent de nombres atòmics va permetre dissenyar la taula periòdica, denominada física per part d'alguns autors. Aquesta ordenació té diferents avantatges respecte de l'anterior ordenació basada en pesos atòmics:
- No té ambigüitat, perquè els nombres atòmics segueixen la successió de nombres naturals.
- No hi ha valors fraccionaris, a diferència del que passava amb els pesos atòmics.
- Desapareixen algunes irregularitats de la taula ordenada per pesos atòmics, en què s'havien de posar elements de més pes atòmic abans que altres de menor pes atòmic, perquè es mantingués la regularitat.
- Quedaven més clares les posicions dels elements vacants encara no descoberts.
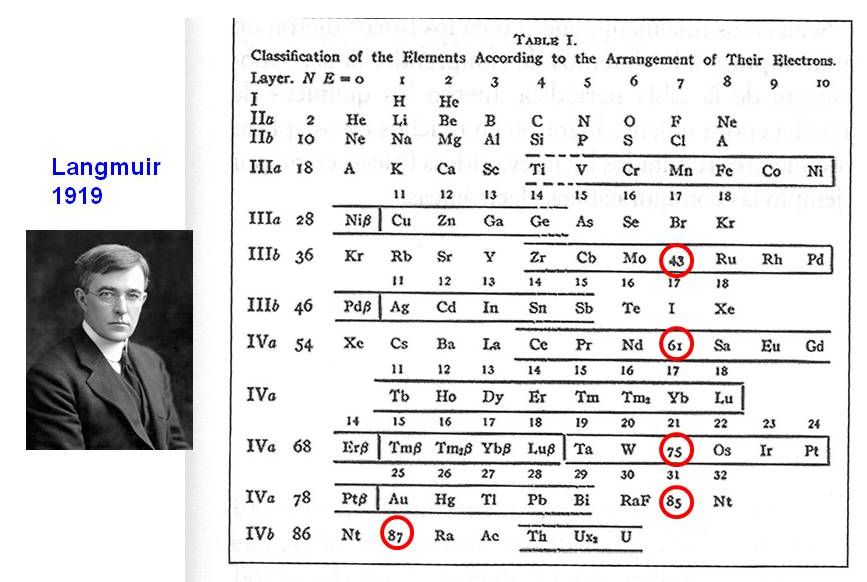
Figura 1. Taula periòdica de Langmuir (1919). És la primera "taula física" basada en l'estructura electrònica. Els elements en vermell eren encara desconeguts. Hi ha molts isòtops que no figuren en les taules periòdiques comunes. Font: Scerri (2007)
La primera taula periòdica basada en l'ordenació per estructures electròniques fou presentada per Langmuir (1919) (figura 1). Des d'aquell moment, i al cap de pocs anys, gairebé totes les taules periòdiques van seguir aquesta ordenació, amb dotzenes de models diferents però totes, sense excepció, tenen els elements ordenats segons la seqüència creixent de nombres atòmics.
Entre els models més difosos hi ha la taula curta, on els elements estan classificats en set files horitzontals o períodes, de l'1 al 7, i en divuit columnes o grups, de l'1 al 18, amb diferents buits deguts a les diferents configuracions electròniques dels àtoms, i amb els metalls lantànids i actínids en dues files normalment sense numerar, situades sota la part principal de la taula periòdica. El motiu principal per fer aquest disseny és el d'economitzar espai en la representació gràfica, i, sospito, que així es facilita la reproducció de la taula periòdica als editors de llibres, perquè és un format aproximadament DIN. Aquest és un disseny derivat del de Von Antropoff (1926) (Mans 2009a), que després utilitzaria Pauling (1947) (figura 2).
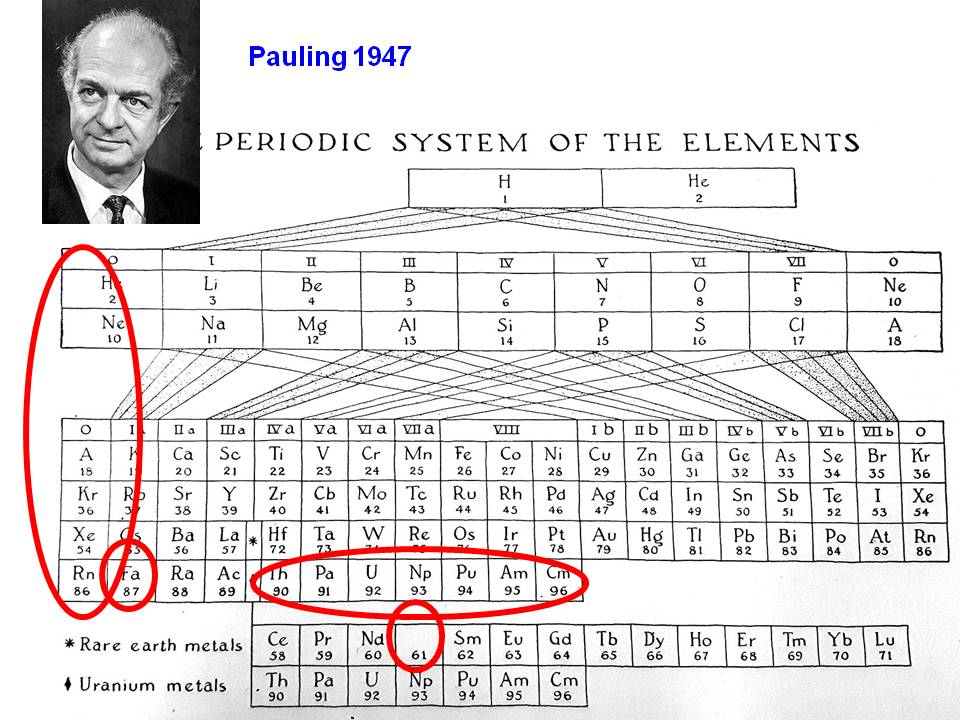
Figura 2. Taula periòdica de Pauling (1947), copiada amb lleus modificacions de la de Von Antropoff. Hi destaca la presència de dues columnes de gasos nobles a dreta i esquerra, i la duplicació dels elements transurànids. Hi falta encara l'element 61, el prometi. Font: Pauling (1947), modificat per l'autor.
Un disseny alternatiu fou el de Seaborg (1945) (figura 3), amb una taula periòdica d'estructura molt similar a la majoria de les actuals. La Wikipedia (2019), en els seus articles sobre elements, inclou l'estructura de taula curta i també la taula llarga de Seaborg ampliada fins a l'element 218 (!) –el biunocti (Buo)–, mentre que l'Encyclopaedia Britannica (2019), en el seu article "Periodic table of Elements", escrit inicialment per Linus Pauling, segueix proposant la taula d'aquest científic, lleument modificada i actualitzada.
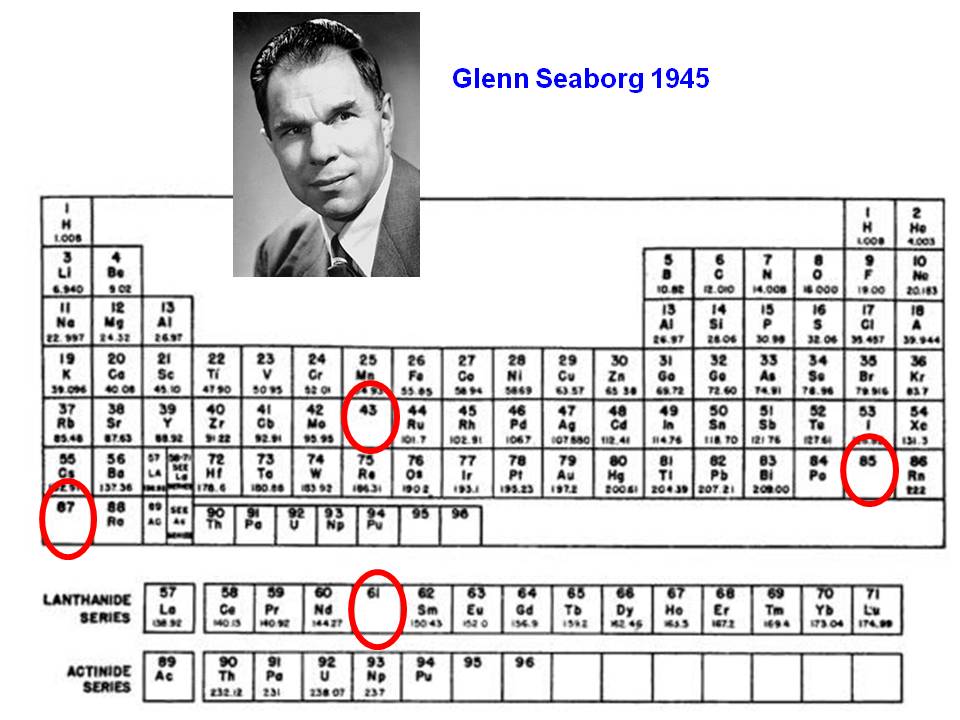
Figura 3 Taula periòdica de Seaborg (1945). És molt similar a les actuals. Destaca el fet que l'hidrogen i l'alumini (Z=13) estan repetits. Hi falten encara el tecneci (43), l'àstat (85) i el franci (87). Font: Chemogenesis, modificada per l'autor.
Diferències entre les taules periòdiques
Les taules periòdiques de format curt, que són les més comunes, semblen totes iguals, però hi ha notables o subtils diferències entre elles. D'entrada, cal indicar que les taules periòdiques són molt diferents pel que fa a quina informació inclouen a cada casella d'element. N'hi ha que posen simplement el nombre atòmic i el símbol i nom. Altres hi posen diferents dades sobre l'estructura atòmica, la massa atòmica, potencials d'ionització, i altres característiques de l'àtom de l'element. Moltes taules afegeixen també dades de densitat, punt de fusió i d'ebullició i altres característiques de la substància elemental més comuna de l'element en qüestió. La distinció entre tots dos grups de propietats no es sol explicitar mai (Mans, 2009b), excepte en la doble taula que Jordi Cuadros, de l'IQS-Universitat Ramon Llull, va publicar fa uns anys i que s'ha reeditat enguany en ocasió de l'Any Internacional de la Taula Periòdica. Al marge d'aquest important detall, hi ha diversos altres aspectes en discussió quant al format de la taula periòdica. N'analitzarem alguns.
1. Classificació dels elements segons el seu estat físic
Moltes taules periòdiques, com la de la Societat Catalana de Química (2018), classifiquen els elements en sòlids, líquids, gasos i sintètics. Això és una imprecisió. Aquestes quatre categories no són excloents entre elles. Hi ha elements sintètics sòlids, com el plutoni (Pu) o l'americi (Am).
2. Quants elements líquids hi ha?
Moltes taules marquen com a líquids els següents: mercuri (Hg), gal·li (Ga), brom (Br), cesi (Cs) i franci (Fr). Aquestes substàncies elementals són totes líquides, però a partir de 30ºC. Les dades de les taules periòdiques, com la densitat, es solen donar a 20ºC, però la consideració de líquid es fa a 30ºC. Sospito que als dissenyadors de taules periòdiques els fa gràcia que a la taula hi hagi més de dos líquids, perquè a 20ºC només el mercuri i el brom ho són.
3. Quants semimetalls o metal·loides hi ha?
Cada taula periòdica indica amb una estructura de línies en escala, des del bor (B) al poloni (Po), la divisió entre metalls i no-metalls, i indica en caselles de colors els elements considerats semimetalls o metal·loides, en nomenclatura antiga. La major part de taules consideren que els semimetalls són B, Si, Ge, As, Sb i Te. Però n'hi ha d'altres que també inclouen Po i At, Se, i fins i tot C i Al. La classificació com a metal·loide o no depèn de la importància que es doni a les característiques químiques de cada substància elemental; per exemple, en el cas de l'alumini, amb evidents propietats de metall, la seva capacitat de donar sals com els aluminats, fa que se'l pugui classificar com a semimetall.
4. On va l'hidrogen en la taula periòdica?
Les especials característiques de l'àtom d'hidrogen i de la substància elemental hidrogen fan que aquest hagi estat un dels punts més discutits i controvertits. A diverses taules periòdiques dels anys trenta, per exemple les d'Estalella, l'hidrogen no hi apareixia perquè no estava clar on posar-lo. En altres ocasions es posava una localització repetida, com a la taula de Seaborg (figura 3) on l'hidrogen encapçala alhora els metalls alcalins i els halògens. Fins i tot se l'ha posat encapçalant el grup 14, sobre el carboni. Hi ha arguments químics per a totes tres localitzacions: actua amb estat d'oxidació +1 i té un cert component metàl·lic en estat sòlid; però té certes similituds amb el fluor com a no-metall; i encara, els potencials d'ionització i l'afinitat electrònica s'acosten als elements del grup 14. Per cert, a la mateixa taula de Seaborg, l'alumini també hi és repetit, sota el bor, on figura habitualment, però també sobre l'escandi al grup 3. Aquest grup 3 és peculiar i objecte del següent paràgraf.
5. Quins elements componen el grup 3?
El fet que els elements posteriors al lantani i a l'actini, respectivament, es solguin ubicar en files inferiors fora del cos principal de la taula, fa que hi hagi diverses opcions per dibuixar el grup 3, que comença amb Sc i Y, però més avall hi ha diverses alternatives (figura 4). La taula de l'SCQ opta per posar a les caselles 57 i 89 els símbols del primer i últim dels lantànids (La-Lu) i actínids (Ac-Lr), respectivament, és a dir 15 elements, detallats a les files inferiors. Altres taules prefereixen posar a les citades caselles només el primer element de cada sèrie, és a dir La i Ac. Altres taules no hi posen cap símbol i hi indiquen "lantànids" i "actínids", respectivament. La proposta més radical és la de Scerri (2006, 2007, 2011). Basant-se en el fet que a la taula llarga (figura 3 inferior) sota el grup 3 hi ha Lu i Lr, confegeix un grup 3 amb Sc, Y, Lu i Lr, i deixa els lantànids amb 14 elements, de La a Yb, i els actínids d'Ac a No. És una opció discutible, no basada en l'estructura electrònica dels àtoms, perquè Lu i Lr tenen 14 electrons f, que els faria candidats a ser a la fila de baix. En canvi, ni La ni Ac tenen electrons f. Aquest argument, però, té un valor relatiu perquè les estructures electròniques dels àtoms, i més dels que tenen electrons en subnivells interiors d i f, mostren moltes irregularitats en la seva periodicitat. Al seu torn la Wikipedia proposa la seva taula llarga, on posa el grup 3 juxtaposat als 1 i 2, i separat dels altres grups 4 a 18. Així, el grup 3 és format per Sc, Y, La i Ac.
Scerri proposa encara un canvi més radical, movent els actuals grups 17 i 18 a l'esquerra de la taula. La taula seria, així, simètrica en estructura, sense que H i He sobresortissin de la taula. El seu argument és que així es mantenen un conjunt de tríades, conjunts de tres elements amb propietats similars i que en aquesta nova estructura es perceben millor. Scerri dona molta importància a les tríades, concepte de Döbereiner de 1820 i que Scerri ha revitalitzat amb molts més exemples (figura 5).
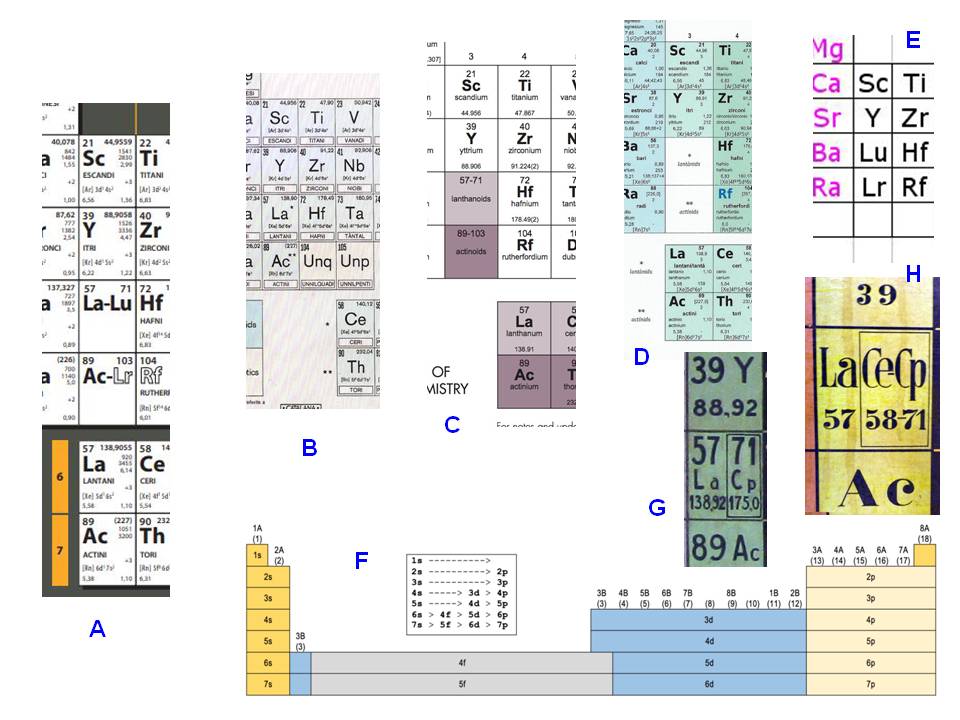
Figura 4. Els elements del grup 3 on es mostren les diferents formes d'omplir les caselles 57 i 89. A: Taula de la Societat Catalana de Química 2018. B: Secció de Química de l'Institut d'Estudis Catalans 1984. C. IUPAC 2018. D: IQS 2019 E: Scerri 2007. F: Wikipedia 2019. G von Antropoff 1925. H: Antropoff, versió cartell 1925. Elaboració de l'autor.

Figura 5. Taula periòdica de Scerri (2006). Poden observar-se les principals modificacions: la posició dels grups halògens i gasos nobles a l'esquerra, el grup 3, i els lantànids i actínids sense els dos elements finals Lu i Lr, passats al grup 3. Font: Chemogenesis
6. Quants lantànids i actínids hi ha?
A conseqüència de les diferents opinions sobre la constitució del grup 3, hi ha taules periòdiques amb 14 o amb 15 elements lantànids i actínids, depenent de si les caselles 57 i 89 estan ocupades per un element, o no.
Les sis controvèrsies o discussions citades deriven del fet de voler mantenir el format curt de la taula periòdica, i alhora, mantenir una certa periodicitat en les propietats dels elements, i l'ordenació seqüencial dels nombres atòmics. Hi ha hagut propostes radicalment diferents, de tota mena, que no mantenen la forma tabular clàssica. Moltes d'aquestes propostes poden consultar-se al web Chemogenesis de Mark L. Leach, amb més de mil models de taula periòdica classificats per ordre cronològic.
Lluny de ser un objecte acabat i consolidat, la taula periòdica està en discussió a molts nivells, i es va modificant no només per la síntesi de nous elements sinó també per nous criteris d'ordenació.
BIBLIOGRAFIA
Antropoff, Andreas von (1926) "Eine neues Form der periodischen Systems der Elemente" Z.Angew.Chem. (1926) 39, 725-728
Encyclopaedia Britannica "Periodic Table of Elements" [+]
Langmuir, I. (1919) "The arrangement of electrons in atoms and molecules" Journal of the American Chemical Society 41, 868-934
Leach, Mark R. (2019) Web Chemogenesis [+]
Mans, Claudi (2009a) "La taula periòdica històrica de la Universitat de Barcelona". Notícies per a Químics, 446, juny-juliol, p. 5-10. [+]
Mans, Claudi (2009b) "Element Al" Educació Química 3, 48-52 [+].
Pauling, Linus (1947) General Chemistry Freeman&Co, i després Dover Books on Chemistry. Nova York.
Scerri, Eric (2006) What if the periodic table starts and ends with triads? PhilSci Archive [+]
Scerri, Eric (2007) The Periodic Table. Its Story and its Signifiance. Oxford University Press
Scerri, Eric (2011) The Periodic Table. A Very Short Introduction. Oxford University Press. Traduït: La tabla periódica: Una breve introducción, Alianza Editorial, El Libro de Bolsillo (2013)
Seaborg, Glenn (1945) Modern Alchemy. Selected Papers of Glenn T. Seaborg, World Scientific Publ. [+]
Societat Catalana de Química (2018) "Taula periòdica 2018" [+]
Wikipedia "Tabla periódica de los elementos ampliada" [+]





