Biologia i genètica 2019
Reescrivint l’ADN
Una de les tècniques que està experimentant un increment d’ús, una optimització tecnològica i una diversificació d’aplicacions més ràpida, però que també està envoltada de qüestions ètiques i legals molt importants, especialment pel que fa a la seva utilització en l’espècie humana, és la que permet editar l’ADN per a introduir-hi canvis dirigits. Aquesta tècnica, coneguda amb el nom de CRISPR-Cas9, permet reescriure fragments de la seqüència de gens in vivo, de manera poc invasiva, per a introduir modificacions planificades, com per exemple corregir mutacions responsables de malalties genètiques. L’any 2019 es van publicar més de 5.000 articles científics que expliquen la utilització d’aquesta tècnica en sistemes biològics no humans i s’hi descriuen millores que n’augmenten l’eficiència i la precisió. Com a comparació, el 2017 se’n van publicar uns 3.500, i dos anys abans, el 2015, uns 1.400 aproximadament.
CRISPR-Cas9 utilitza un mecanisme propi de les cèl·lules que els permet reparar danys en l’ADN, anomenat sistema d’edició d’un parell de bases. La idea bàsica és modificar químicament un nucleòtid d’una cadena perquè el sistema natural de reparació d’ADN de la cèl·lula el repari, i, en fer-ho, introdueixi el canvi desitjat (per a una descripció més acurada del procés, es pot consultar l’article “Biologia i genètica” de l’Anuari del 2017). Aquest sistema permet minimitzar el risc que es produeixin mutacions per error, malgrat que la seva eficiència és encara baixa.
En aquest sentit, el 2019 es van presentar modificacions en el sistema CRIPR-Cas9 que incrementen significativament la seva eficiència. Per exemple, un equip de l’Institut de Tecnologia de Massachusetts i de la Universitat de Harvard, als EUA, ha desenvolupat un nou sistema enzimàtic que combina el clàssic CRISPR-Cas9 amb una transcriptasa inversa que n’incrementa l’eficiència fins gairebé el 90%. La transcriptasa inversa és un enzim que es troba en diversos organismes en la natura i que permet copiar cadenes d’ARN a ADN. L’utilitzen, per exemple, diversos virus d’ARN per a introduir una còpia del seu genoma dins el genoma de les cèl·lules hoste que infecten, que és fet d’ADN. Aquest nou sistema d’edició gènica permet modificar fragments més llargs d’ADN de manera molt més precisa, utilitzant una molècula d’ARN sintetitzada al laboratori com a motlle guia. Aquest avenç podria permetre una utilització molt més àmplia i segura en embrions humans per a corregir malalties d’origen genètic.
En aquest context, s’ha provat amb èxit en embrions humans que estaven afectats d’una malaltia genètica, la β-talassèmia, els quals no van ser mai implantats perquè es desenvolupessin, ateses les restriccions legals que hi ha en molts països. Tanmateix, l’octubre del 2018 es va produir el naixement a la Xina de dues nenes, que es coneixen amb el sobrenom de Lulu i Nana, que havien estat editades genèticament. En aquest país, i també en altres països asiàtics com l’Índia i el Japó, hi ha una regulació que no prohibeix explícitament la implantació d’embrions humans editats genèticament. L’investigador responsable, He Jiankui, va assegurar que se’ls havia alterat un receptor cel·lular anomenat CCR5, la qual cosa les feia resistents a la infecció del VIH, el virus responsable de la sida. Tanmateix, al final del 2019 es va saber que, dels quatre embrions que l’equip de He Jiankui va intentar modificar, en dos no es va aconseguir alterar la seqüència d’ADN que codifica per aquest receptor, i, en els altres dos, que van ser implantats i dels quals van néixer la Lulu i la Nana, la modificació que es va produir no era exactament la planificada. Tot plegat ha fet que des de diversos sectors socials, inclosos els responsables de les polítiques científiques, s’hagi demanat una regulació més clara i un seguiment més exhaustiu de la utilització de la tècnica d’edició genètica en persones, atès que es perfila com una tècnica molt potent i versàtil en biomedicina.
Aprofundint en l’arquitectura morfològica i molecular del cervell
El cervell, l’òrgan més complex del cos humà pel que fa al seu funcionament, és l’òrgan de la pensa. Del seu funcionament, que es basa en les connexions sinàptiques entre les neurones que el formen, sorgeixen tots els processos cognitius i les facultats mentals. Constitueix, per tant, l’origen biològic de l’enorme repertori cognitiu i de comportaments que presenta l’espècie humana, inclosa la susceptibilitat a manifestar alteracions psiquiàtriques i malalties neurodegeneratives. Per a entendre l’arquitectura morfològica del cervell, el juliol del 2009 es va iniciar el Projecte Connectoma Humà, amb l’objectiu de construir un mapa de connexions neuronals (el connectoma) que contribueixi a clarificar la connectivitat anatòmica i funcional del cervell en condicions normals, per a poder-ho utilitzar en l’estudi d’alteracions patològiques. El projecte es va donar per conclòs el juliol del 2019. En aquest període es va analitzar el connectoma de més d’un miler de persones, la qual cosa va generar de manera directa o indirecta més de 4.000 articles científics.
Una de les principals conclusions del projecte és la gran heterogeneïtat pel que fa a les connexions sinàptiques particulars de cada persona, atès que moltes es van construint de manera dinàmica durant tota la vida en funció dels condicionants ambientals i de les experiències pròpies de cadascú. Però també ha fet evident l’existència de grans feixos de connexions que es mantenen força invariables en persones que no mostren cap tipus de patologia cerebral. Precisament aquestes regularitats són les que han començat a ajudar a entendre quines alteracions es produeixen en els trastorns psiquiàtrics i en les malalties neurodegeneratives, ja sigui com a causa o com a conseqüència, la qual cosa està començant a tenir grans repercussions en biomedicina.
El 2015 es va iniciar un altre projecte relatiu al cervell humà, anomenat PsychENCODE (acrònim d’Enciclopèdia dels Elements de l’ADN relacionals amb trastorns psiquiàtrics). El seu objectiu és identificar les variants gèniques implicades en la predisposició a tenir trastorns psiquiàtrics, com esquizofrènia, psicosi, depressió greu i trastorn bipolar, entre d’altres, i altres trastorns que afecten el comportament, com l’autisme i l’anorèxia. Dit d’una altra manera, si el Projecte Connectoma Humà ha analitzat la connectivitat morfològica del cervell, el PsychENCODE pretén disseccionar-ne els aspectes genètics i moleculars. Malgrat que des del 2015 s’han anat publicant molts resultats, el gruix més important es va fer públic al final del 2018 i durant tot el 2019.
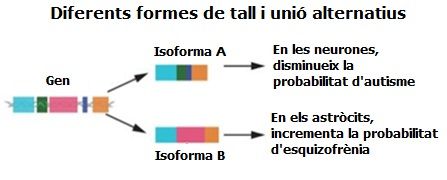 Esquema simplificat d’un cas de tall i unió alternatius d’un mateix gen que afavoreix la manifestació d’esquizofrènia (SCZ) o d’autisme (ASD), segons el tipus cel·lular en què es produeix
Esquema simplificat d’un cas de tall i unió alternatius d’un mateix gen que afavoreix la manifestació d’esquizofrènia (SCZ) o d’autisme (ASD), segons el tipus cel·lular en què es produeix
Algunes de les descobertes van mostrar que en algunes de les variants gèniques que afavoreixen la manifestació de trastorns psiquiàtrics es produeixen problemes de tall i unió de l’ARN primari, la qual cosa genera proteïnes anòmales. Durant el procés de transcripció de la informació codificada de l’ADN a l’ARN missatger, que és qui dirigirà la fabricació de la proteïna corresponent, es genera un ARN primari que abans de ser funcional ha de ser processat. Aquest processament inclou l’eliminació dels introns (que son les seqüències d’ADN que no duen informació per a fabricar la proteïna) i la unió dels exons resultants (que sí que duen informació). En aquest procés, que s’anomena tall i unió (splicing, en anglès), tot sovint es produeixen fenòmens de tall i unió alternatius, en què determinats exons són eliminats com si fossin introns o alternativament es mantenen com a exons. És un procés programat que permet incrementar el nombre de proteïnes diferents que es fabriquen a partir d’un mateix gen. Cada cèl·lula o cada tipus cel·lular acaba produint només els ARN missatgers que necessita, que determinen les proteïnes que s’acabaran fabricant i, en conseqüència, la funcionalitat global de les cèl·lules. Doncs bé, un dels resultats més destacats és que en un nombre significatiu d’ocasions les alteracions en aquest sistema de tall i unió alternatius afavoreixen la manifestació de trastorns psiquiàtrics.
Un altre dels resultats més destacats va ser la constatació que en altres ocasions la predisposició a manifestar trastorns psiquiàtrics és deguda a modificacions epigenètiques, que alteren la funcionalitat dels gens sense canviar la seqüència de nucleòtids que els formen. Les modificacions epigenètiques consisteixen en l’addició de determinades molècules a l’ADN (grups metil) o a les proteïnes histones que l’acompanyen (grups metil o acetil, entre d’altres), les quals contribueixen a regular la seva funcionalitat. En aquest sentit, moltes modificacions epigenètiques s’estableixen en interacció amb l’ambient, incloses les experiències vitals, la qual cosa emfasitza la importància ambiental en la manifestació de trastorns psiquiàtrics en persones que tenen unes mateixes variants gèniques. Per exemple, s’ha vist que la criança negativa, que es defineix com la relació basada en la poca o nul·la calidesa afectiva, en la indiferència o la negligència i en el rebuig o l’hostilitat cap als fills, en contraposició a la positiva, que implica l’afectivitat basada en la confiança i la cura no sobreprotectora i en la coherència entre recompenses i amonestacions de caràcter educatiu, afavoreix l’establiment de modificacions epigenètiques en aproximadament un centenar de gens que fan que s’incrementi de manera molt acusada la probabilitat de tenir depressió.
Adaptant-se a l’oxigen
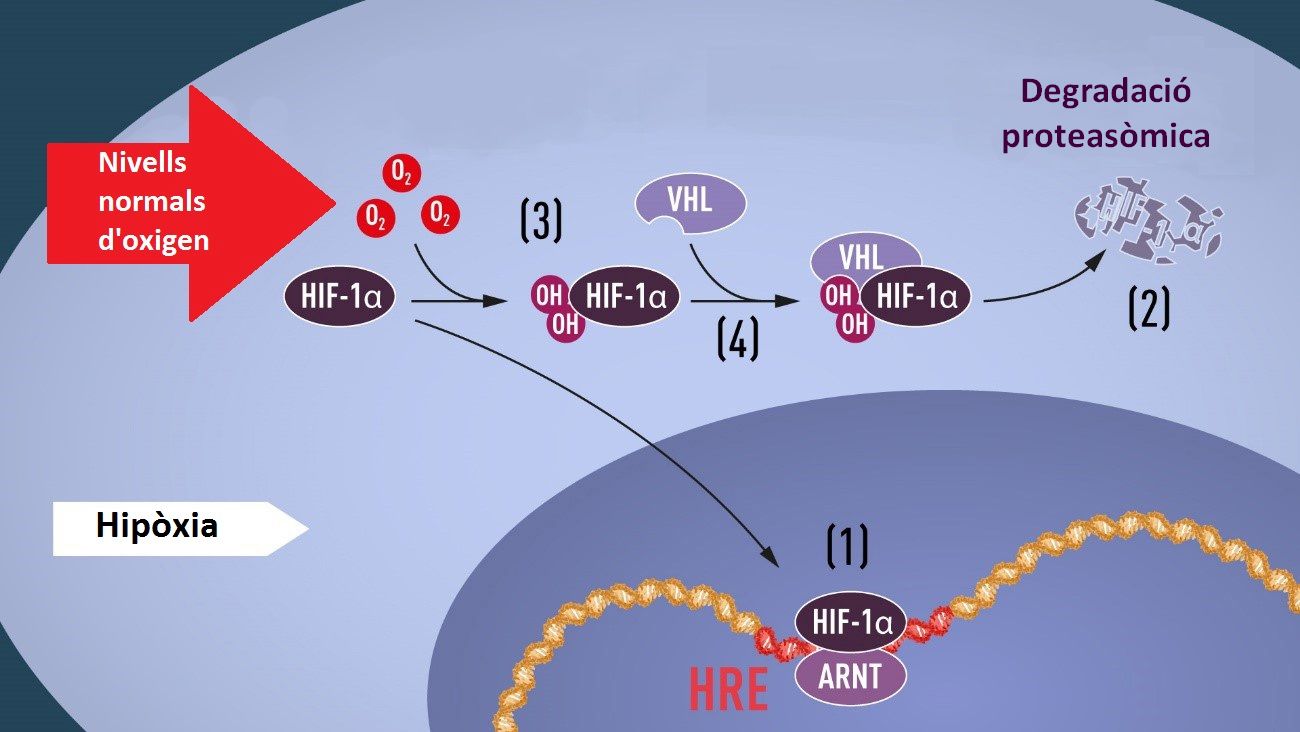 Representació del mecanisme bàsic de funcionament del sistema que monitoritza la quantitat d’oxigen i activa els mecanismes de resposta necessaris. En condicions d’hipòxia, quan els nivells d’oxigen són baixos, el factor HIF està protegit de la degradació i s’acumula al nucli, on regula els gens necessaris per a fer front a la situació (1), entre els quals hi ha l’eritropoetina. Quan els nivells d’oxigen són normals, el factor HIF és degradat ràpidament en un complex enzimàtic anomenat proteasoma (2). Això és causat per la proteïna VHL, que forma un complex amb HIF quan els nivells d’oxigen són normals i la condueix cap a la degradació (3 i 4)
Representació del mecanisme bàsic de funcionament del sistema que monitoritza la quantitat d’oxigen i activa els mecanismes de resposta necessaris. En condicions d’hipòxia, quan els nivells d’oxigen són baixos, el factor HIF està protegit de la degradació i s’acumula al nucli, on regula els gens necessaris per a fer front a la situació (1), entre els quals hi ha l’eritropoetina. Quan els nivells d’oxigen són normals, el factor HIF és degradat ràpidament en un complex enzimàtic anomenat proteasoma (2). Això és causat per la proteïna VHL, que forma un complex amb HIF quan els nivells d’oxigen són normals i la condueix cap a la degradació (3 i 4)
Tots els animals i molts altres organismes necessiten oxigen per a convertir els elements energètics de l’aliment que ingereixen en energia metabòlica utilitzable per a la resta de sistemes corporals. El nivell fisiològic d’oxigen, però, canvia constantment i sovint de manera dràstica, en funció no tan sols de l’exterior, sinó també de manera molt destacada de l’estat i de les necessitats metabòliques de cada instant. Això fa que les cèl·lules necessitin reconèixer i avaluar amb rapidesa i precisió de quina quantitat d’oxigen disposen i quant en necessiten en cada instant. Se sap que determinades alteracions en el sistema de sensors encarregat d’aquesta avaluació causen algunes malalties metabòliques, com algunes formes d’anèmia. El 2019, el premi Nobel de medicina i fisiologia va ser concedit a William G. Kaelin Jr., Sir Peter J. Ratcliffe i Gregg L. Semenza per les seves contribucions a la comprensió dels sistemes moleculars que permeten a les cèl·lules avaluar i adaptar-se als canvis en la concentració d’oxigen. Algunes de les seves troballes més significatives, que han quedat plasmades en més de 60 articles científics, inclouen el paper de l’hormona eritropoetina (EPO) en la regulació de la producció de glòbuls rojos (o eritròcits), que són les cèl·lules encarregades de transportar l’oxigen per la sang; del factor induïble per hipòxia (HIF), que regula l’eritropoetina en funció del nivell d’oxigen dins les cèl·lules del cos; i de la proteïna VHL, que quan està alterada incrementa la probabilitat de tenir determinats tipus de càncer i que en condicions normals té la funció de modificar el factor HIF en funció també de la concentració d’oxigen.
Autor: David Bueno i Torrens



